Jelaskan Perbedaan Model Atom Thomson, Rutherford, Niels Bohr!
Model Atom Thomson
Pada awal abad ke-20, JJ Thomson menggambarkan atom seperti bola pejal, yaitu bola padat yang bermuatan positif. Di permukaannya, tersebar elektron yang bermuatan negatif. Thomson membuktikan adanya partikel yang bermuatan negatif dalam atom.
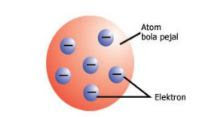 |
| Model Atom Thomson |
Namun sayangnya teori atom Thomson juga memiliki kekurangan, yaitu
- tidak adanya lintasan elektron dan tingkat energi.
- tidak dapat menjelaskan susunan muatan positif dan negatif dalam atom.
Baca Juga: Ringkasan Materi Kimia
Model Atom Rutherford
Ernest Rutherford, ahli fisika kelahiran Selandia Baru adalah salah satu tokoh yang berjasa dalam pengembangan model atom. Rutherford membuat model atom seperti tata surya.
 |
| Model Atom Rutherford |
- Atom adalah bola berongga yang tersusun dari inti atom dan elektron yang mengelilinginya.
- Inti atom bermuatan positif. Selain itu, massa atom terpusat apda inti atom.
- Model ini persis seperti bagaimana planet mengelilingi matahari. Rutherford berjasa mengenalkan konsep lintasan atau kedudukan elektron yang kelak disebut dengan kulit atom. Namun model atom Rutherford tidak dapat menjelaskan mengapa elektron tidak jatuh ke dalam inti atom.
Baca Juga: Ringkasan Materi Kimia
Model Atom Niels Bohr
Niels Bohr, ahli fisika dari Denmark adalah ilmuwan pertama yang mengembangkan teori struktur atom pada 1913. Teori tentang sifat atom yang didapat dari pengamatan Bohr:
- Atom terdiri dari inti yang bermuatan positif dan dikelilingi oleh elektron yang bermuatan negatif di dalam suatu lintasan.
- Elektron bisa berpindah dari satu lintasan ke lintasan yang lain dengan menyerap atau memancarkan energi sehingge energi elektron atom itu tidak akan berkurang
- Jika berpindah ke lintasan yang lebih tinggi, elektron akan menyerap energi.
- Jika berpindah ke lintasan yang lebih rendah, elektron akan memancarkan energi.
- Kedudukan elektron-elektron pada tingkat-tingkat energi tertentu yang disebut
- kulit-kulit elektron.
 |
| Model Atom Niels Bohr |
menunjukkan bahwa atom terdiri dari beberapa kulit. Kulit ini adalah tempat berpindahnya elektron. Kesimpulan yang diperoleh adalah selama elektron- elektron berada di lintasan energinya relatif tetap.
Elektron-elektron yang berputar mengelilingi inti atom berada pada lintasan atau tingkat energi tertentu yang kemudian dikenal dengan sebutan kulit atom.
Dasar inilah yang digunakan untuk menentukan konfigurasi elektron suatu atom.Namun model atom Bohr memiliki Kelemahan,yaitu :
- Adanya radius dan orbit. Ini tidak sesuai dengan Prinsip Ketidakpastian Heisenberg yang menyatakan radius tidak bisa ada bersamaan dengan orbit.
- Selain itu, model atom Bohr juga tidak menjelaskan Efek Zeeman. Efek Zeeman adalah ketika garis spektrum terbagi karena adanya medan magnet
Posting Komentar